|
Раздел в работе Теперь студенты могут изучать базовые научные принципы на том же оборудовании мирового класса, которое используется ведущими исследователями в университетах и государственных лабораториях, в частности, в лабораториях NASA. Прогресс в электрооптике оказывает постоянное влияние на технику измерений. Благодаря быстродействующим матричным детекторам, дешевым оптическим волокнам и мощным компьютерам, оптическая спектроскопия стала предпочтительным методом измерений во многих практических задачах... Скачать статью (*.pdf)
В области разработки и маркетинга научных приборов также произошли кардинальные изменения. В прошлом, передовые измерительные приборы появлялись на рынке в виде дорогих лабораторных устройств, доступных только хорошо финансируемым организациям. Со временем новые технологии проникли в лабораторные приборы общего назначения, а затем и в учебные установки.
Наши знания в области спектроскопии основаны на многолетних экспериментах в самых разных сферах человеческой деятельности — от искусства до прикладной физики. Фундаментом любой сферы деятельности является образование, а конкретнее, обучение основам выбранной специальности. Тысячи преподавателей, использовавших спектрометры Ocean Optics в своих учебно-практических занятиях, убедились на собственном опыте, что эти занятия обогатили жизнь студентов и позволили им лучше понять, что такое наука.
Очень важно, чтобы сегодняшние студенты научных и технических специальностей оценили достоинства оптических методов измерений, поняли физические основы измерений, научились правильно выбирать и интегрировать компоненты и усвоили дисциплину, необходимую для получения качественных результатов. Данное руководство призвано помочь будущему ученому изучить основы спектроскопии, работая на современном измерительном оборудовании, применяемом в науке и промышленности.
Часть A знакомит с основными принципами и примерами использования спектроскопии. Часть B содержит описания экспериментов, которые могут быть включены в традиционный учебный курс для ознакомления студентов с оптическими измерениями. Часть A
Концепции спектроскопии
Введение В основе научных открытий лежат наблюдения. Ученые ищут закономерности в том, что они видят, слышат, чувствуют, обоняют и осязают, чтобы формулировать теории и делать предсказания. Сначала ученые полагались исключительно на собственные органы чувств, но по мере развития науки они стали разрабатывать приборы, которые позволили выйти за рамки этих ограничений. Телескопы помогли астрономам лучше рассмотреть небо и значительно улучшили наше понимание того, что же такое небеса. Точно так же, микроскопы дали биологам возможность рассматривать все более мелкие частицы организмов в поисках знаний об устройстве живых систем.
Астрономы ограничены только размерами телескопов, которые они могут построить, и искажающим воздействием земной атмосферы. Благодаря техническим достижениям, позволившим создавать зеркала больших размеров и космические платформы, астрономы могут заглядывать все дальше в пространство и делать все больше и больше открытий. К сожалению, если мы посмотрим в противоположном направлении, то там ситуация окажется совсем другой. Существует физический предел для размеров предметов, которые можно «увидеть». Этот предел связан с природой самого света.
Свет
Свет представляет собой электромагнитное излучение. Он состоит из фотонов, маленьких сгустков энергии, которые обладают свойствами как частиц, так и волн. Все волны имеют определенную длину волны — длину одного полного цикла колебаний. Диапазон возможных длин волн света огромен. На рис. 1 показаны все известные длины волн электромагнитного излучения, а также традиционные названия излучений с различными длинами волн.
Именно волновые свойства света ограничивают нашу способность использовать его для создания изображений. Для любой заданной длины волны можно сформировать изображение только тех предметов, размер которых превышает эту длину волны. С помощью видимого света (длины волн примерно от 4 ´ 10–7 до 7 ´ 10–7 м) невозможно сформировать изображения атомов, которые имеют размер порядка 10–9 м. Самые маленькие предметы, которые мы можем увидеть при помощи оптических приборов — это очень большие молекулярные сборки, такие как хромосомы (молекулы ДНК, покрытые слоем молекул протеина).
Задача, стоящая перед химиками, биохимиками и микробиологами, заключается в понимании того, что происходит на атомном и молекулярном уровне без визуального наблюдения за атомами и молекулами. Хотя мы не можем фотографировать атомы и молекулы, мы можем использовать свет для изучения их внутренней структуры. Это связано с тем, что атомы и молекулы способны поглощать или испускать свет. Регистрируя этот свет, мы можем определять, какие вещества участвовали в поглощении или испускании. Методы регистрации такого света именуются спектроскопией. Это единственный инструмент, имеющийся у астрономов для сбора информации о космосе. Это самый мощный инструмент, имеющийся у ученых для изучения атомов и молекул. Спектроскопия широко применяется как в науке, так и в технике. 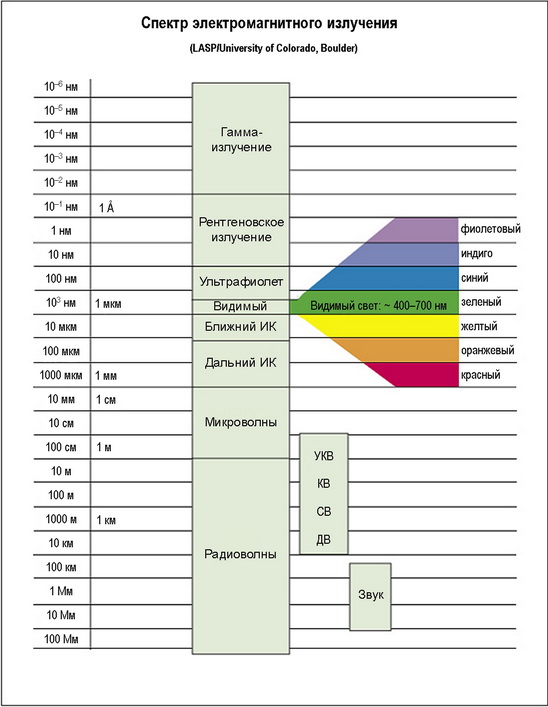
Рис. 1. Диапазоны длин волн электромагнитного излучения Длина волны и энергия
Понимание природы света возникло относительно недавно. Долгое время различные виды электромагнитного излучения рассматривались как отдельные явления. В результате мы имеем множество названий для разных диапазонов длин волн. Причина этого в том, что энергия фотона обратно пропорциональна длине волны:
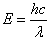 , (1) , (1)
где:
E — энергия фотона (в джоулях);
λ — длина волны (в нанометрах);
h — постоянная Планка;
c — скорость света. Чем короче длина волны, тем выше энергия фотона.
Диапазон длин волн известного электромагнитного излучения огромен, и различие в энергии фотонов также огромно. А именно эта энергия и определяет результат взаимодействия фотона с веществом. Радиочастотные фотоны обладают очень маленькой энергией, благодаря чему мы можем насыщать ими нашу атмосферу без заметного воздействия на окружающую среду. Количество энергии, которое они передают поглощающим их атомам, почти равно нулю. Инфракрасные фотоны обладают достаточной энергией для нагрева предметов и, как результат, они позволяют создавать отличные инфракрасные нагреватели. Ультрафиолетовые фотоны обладают достаточной энергией для разрушения химических связей и могут вызывать молекулярную перестройку, приводящую к таким эффектам, как солнечный ожог или генетические повреждения. Рентгеновские лучи обладают очень большой энергией и легко разрывают даже самые прочные связи, вызывая значительные молекулярные разрушения, в том числе и в живых тканях. По этой причине применение рентгеновских лучей в медицине должно осуществляться очень аккуратно и только в чрезвычайно малых дозах.
Взаимодействие света с материей
Если говорить точнее, то за поглощение и испускание фотонов света атомами и молекулами обычно отвечают электроны (гамма-лучи обладают достаточной энергией для взаимодействия с ядрами атомов, но мы оставим эту тему для изучения физикам). Электрон может поглощать фотоны с низкой энергией (например, радиочастотные) за счет переворота своего спина. Этот эффект используется в спектроскопии ядерного магнитного резонанса (ЯМР) и магниторезонансной томографии. Электрон может также поглощать инфракрасные, видимые и ультрафиолетовые фотоны, изменяя свое энергетическое состояние. Каждый электрон может занимать ряд определенных энергетических уровней. Уровень с самой низкой энергией называется основным состоянием. Энергия самого высокого уровня называется энергией ионизации. Это энергия, необходимая для полного удаления электрона из атома. Чтобы электрон перешел с одного уровня на другой, более высокий, он должен поглотить энергию, равную разности энергии этих уровней. Точно так же, чтобы перейти на более низкий уровень, электрон должен испустить энергию, равную разности энергии уровней. Поскольку количество уровней, которые электрон может занимать, ограничено, то ограничено и количество энергии, которое он может поглощать или отдавать.
Более подробное обсуждение этого вопроса можно найти, например, в главе 7 книги Chemistry and Chemical Reactivity (авторы Kotz, Treichel). Рисунок 7.13 из этой книги дает подробное представление об электронных переходах, возможных для простейшего атома — атома водорода. На рис. 2 показана самая общая схема переходов атома натрия. Переход 3s->4p лежит в ультрафиолетовом диапазоне, а переход 3p->3d — в инфракрасном диапазоне. Переход 3s->3p дает излучение в оранжевой области видимого спектра. Именно эта спектральная линия отвечает за характерный цвет натриевых осветительных ламп. 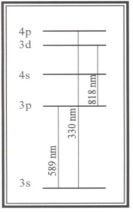
Рис. 2. Электронные переходы атома натрия Электрон может приобрести или потерять энергию многими путями. Здесь нас будет интересовать поглощение или испускание света. Электрон может поглотить фотон света, который сталкивается с ним, только если этот фотон обладает точно таким количеством энергии, которое необходимо для перехода электрона на более высокий разрешенный уровень. Электрон, уже находящийся на более высоком уровне, может испустить фотон света с энергией, в точности равной разности энергий с одним из нижележащих разрешенных уровней. Следует отметить, что электрон в основном состоянии не может испускать никаких фотонов, поскольку он уже имеет минимально возможную энергию.
Разность энергий разрешенных уровней определяет, какое излучение нужно использовать для изучения данных атомов и молекул. Хотя спектроскопия работает почти во всех диапазонах электромагнитного спектра, по практическим соображениям в химических лабораториях используют в основном инфракрасный, видимый и ультрафиолетовый диапазоны.
Инфракрасная спектроскопия особенно полезна для изучения связей между атомами углерода, водорода, кислорода и азота, доминирующими в органических соединениях. Таким образом, инфракрасное излучение является основным инструментом химика-органика. Инфракрасные спектры могут указывать на наличие определенных структур в неизвестных органических соединениях. Они также могут использоваться для идентификации соединений путем сравнения с известными спектрами. Для этих целей имеются справочники, содержащие тысячи спектров.
Спектроскопия видимого диапазона применяется при изучении некоторых типов органических соединений и элементов, которые имеют электроны в d-орбиталях, таких как переходные металлы.
Ультрафиолетовая спектроскопия полезна при изучении некоторых типов органических соединений, которые доминируют в биологических средах. Все протеины, а также ДНК и многие продукты реакций имеют информативные ультрафиолетовые спектры. За многими биохимическими реакциями можно эффективно наблюдать в ультрафиолетовой области, и соответствующие приборы обычно присутствует в биохимических лабораториях. В клинических лабораториях ультрафиолетовая спектроскопия часто применяется для проведения количественных анализов плазмы крови и мочи. Виды спектроскопии
Спектроскопия — это исследование взаимодействия света с веществом. У этого взаимодействия есть два различных аспекта, которые могут быть использованы для изучения атомов и молекул. Во-первых, можно определять длины волн, которые взаимодействуют с атомами и молекулами (качественный анализ). Во-вторых, можно измерять количества света, поглощенного или излученного на какой-либо определенной длине волны (количественный анализ). В обоих случаях требуется выделять из излучения источника отдельные длины волн, поэтому главным этапом любого спектроскопического измерения является разложение света в спектр. В каждом из двух случаев есть два пути проведения наблюдений: можно регистрировать свет, который поглощается атомами и молекулами, или свет, который испускается. В итоге мы имеем четыре разных вида спектроскопии: абсорбционную и эмиссионную, каждая из которых может быть качественной или количественной.
Абсорбционная спектроскопия
Абсорбционная спектроскопия — это изучение света, поглощенного молекулами. При этом белый свет сначала пропускается через образец, а затем через спектральное устройство (например, призму), которое разлагает его в спектр. Вспомните, что белый свет является смесью всех длин волн видимого излучения. Когда такой свет пропускается через образец при правильных условиях, электроны образца поглощают те длины волн, которые могут перевести их на другие уровни. Таким образом, у света, выходящего из призмы, будут отсутствовать длины волн, которые соответствуют разрешенным энергетическим уровням электронов. Мы увидим спектр с черными линиями в тех местах, где при отсутствии образца был бы свет.
Эмиссионная спектроскопия
Эмиссионная спектроскопия противоположна абсорбционной спектроскопии. Электроны образца переводятся на очень высокие энергетические уровни одним из многочисленных методов (электрическим разрядом, нагревом, излучением лазера и т. д.). При возвращении на более низкие уровни электроны испускают свет. Собирая этот свет и пропуская его через призму, можно получить спектр. Однако на этот раз мы увидим только темное поле с цветными линиями, которые соответствуют электронным переходам. На рис. 3 показано, как выглядит через окуляр спектроскопа линия испускания гелия (589 нм). Следует отметить, что спектры поглощения и испускания одного и того же вещества будут иметь линии на одинаковых длинах волн. В спектре поглощения эти линии будут черными на цветном фоне, тогда как в спектре испускания они будут цветными на темном фоне.
Рис. 3. Линия испускания гелия (589 нм), видимая через окуляр спектроскопа. Качественная спектроскопия
Одно из практических применений спектроскопии основано на том факте, что спектры химических веществ уникальны. Одинаковые атомы и молекулы будут всегда иметь одни и те же спектры. Разные вещества всегда будут иметь разные спектры. Таким образом, спектр какого-либо вещества может рассматриваться как его «дактилоскопический отпечаток». Качественная спектроскопия используется для идентификации химических веществ путем создания спектра и сравнения его с уже известными спектрами.
В качестве примера рассмотрим открытие такого элемента, как гелий. Впервые его наблюдали не на Земле, а на Солнце! В 1868 г. французский астроном Пьер-Жюль-Сезар Жансен был в Индии, где наблюдал солнечное затмение. При этом он обнаружил новые линии в солнечном спектре. Ни один из известных в то время элементов не давал таких линий, и поэтому он пришел к выводу, что на Солнце есть новый элемент. Это послужило стимулом к поиску нового элемента на Земле. К концу века новый элемент был обнаружен в урановых рудах и получил название гелий, от греческого слова, обозначающего солнце (Helios). В наши дни спектроскопия широко применяется для идентификации химических веществ.
Количественная спектроскопия
Количественная спектроскопия служит одним из наиболее быстрых и легких методов определения количества атомов или молекул в образце. Дело в том, что взаимодействие света с веществом является стехиометрическим. При любой заданной температуре одно и то же число атомов или молекул будет испускать или поглощать одно и то же количество фотонов за данный промежуток времени. Благодаря этому спектроскопия является одним из немногих методов, обеспечивающих прямое измерение количества атомов или молекул в образце.
Количественная эмиссионная спектроскопия требует нагрева образца до высокой температуры, чтобы электроны могли испускать свет. Чаще всего это делается введением образца в пламя горелки. Очевидно, что горелку непрактично использовать для большинства молекулярных соединений, но она часто применяется для элементарного анализа. Данный метод (пламенная фотометрия) применяется, в частности, в клинических лабораториях для определения уровней натрия и калия в плазме крови и моче.
Рис. 4. Создание пламенной эмиссии. Количественный абсорбционный анализ, напротив, может проводиться при комнатной температуре, и поэтому он применяется намного чаще. Обычно анализу подвергаются растворы образцов. Этот вид анализа используют, например, в клинических лабораториях для определения количества глюкозы и холестерина в крови и моче.
В абсорбционной спектроскопии через образец пропускается свет всех длин волн и измеряется поглощение на каждой длине волны. Сделанное выше утверждение о том, что спектр поглощения выглядит как набор черных линий на цветном фоне, является чрезмерно упрощенным. Из-за сложных взаимодействий атомов и молекул с молекулами воды, поглощение света в растворах представляет собой очень сложное явление.
Несмотря на это, спектры поглощения повторяемы и предсказуемы, что позволяет использовать их на практике. Измерив поглощение на разных длинах волн и нанеся результаты на график, можно получить так называемую кривую поглощения.
Пример такой кривой приведен на рис. 5. Кривые поглощения сходны с дактилоскопическими отпечатками. Каждое соединение имеет свою собственную уникальную кривую. В некоторых случаях она может быть использована для идентификации веществ, присутствующих в образце. Однако чаще всего она используется для определения количества присутствующего вещества.
Рис. 5. Спектр поглощения гемоглобина в видимой области. Цвет и длина волны
Изучение спектроскопии удобно начинать с видимой области спектра, поскольку именно эта область определяет одно из основных свойств окружающего мира: его окраску. Наше восприятие цвета связано с тем, что глаз по-разному реагирует на свет с разными длинами волн. Когда фотоны из узкого диапазона длин волн взаимодействуют с нашей сетчаткой, мы воспринимаем это как цвет. Таким образом, видимый цвет предмета определяется длинами волн фотонов, излученных или отраженных данным предметом и достигших наших глаз. В некотором смысле наши глаза работают как спектрометры.
Белый свет — это смесь равных долей света всех длин волн (цветов). Когда такой свет падает на предмет и полностью им отражается, мы воспринимаем предмет как белый. Если предмет поглощает весь падающий свет, то в наши глаза ничего не попадает и мы воспринимаем предмет как черный. Листок бумаги белый, потому что падающий на него свет равномерно отражается, и почти ничего не поглощается. Буквы на бумаге черные, потому что они равномерно поглощают почти весь падающий свет. Цвет мы воспринимаем в том случае, когда некоторые длины волн отражаются (или пропускаются, как в случае растворов) сильнее, чем другие.
Кривая поглощения света цветными предметами имеет довольно сложную форму. Утверждение «предмет выглядит красным, потому что весь красный свет отражается, а весь остальной свет поглощается», является чрезмерным упрощением. На самом деле, большинство цветных предметов поглощают в той или иной степени свет самых разных длин волн, а видимый цвет определяется в основном тем, какие длины волн сильнее поглощаются, а не отражаются.
Работа мозга по присваиванию предметам цветов описывается теорией дополнительного цветового зрения. Согласно этой теории, каждый цвет имеет так называемый дополнительный цвет. Это часто демонстрируют при помощи «цветового круга», пример которого показан на рис. 6. Дополнительные цвета нанесены на круге с противоположных сторон. В процессе восприятия цвета зрительный нерв и мозг сравнивают количество света, имеющего некоторый цвет, с количеством света, имеющего дополнительный цвет. Если обе величины одинаковы, мы видим серый или белый цвет. Если нет — мы видим какой-либо другой цвет. Например, огнетушитель выглядит при белом освещении красным, потому что сине-зеленый свет (дополнительный к красному) поглощается сильнее, чем какого-либо другой. Конечно, это означает также, что красный свет отражается сильнее, чем сине-зеленый. Для всех остальных цветов в этом примере коэффициенты отражения основного и дополнительного цвета примерно равны. Рис. 6. Цветовой круг. Приборы, которые создают спектры
В спектроскопии используется много различных приборов. Они сильно отличаются по количеству предоставляемой информации, но все имеют одну общую черту: способность разлагать свет на компоненты с разными длинами волн.
Спектроскопы
Спектроскоп — это простейший спектроскопический инструмент. Его назначение в том, чтобы разлагать свет от любого источника в спектр, доступный для наблюдения невооруженным глазом. На рис. 7 приведена схема простого спектроскопа. Свет от источника проходит через щель и попадает в призму, где происходит разложение в спектр. Телескоп используется для наблюдения света, выходящего из призмы. Третье плечо содержит шкалу длин волн, которая наложится на спектр, если пропустить через нее белый свет. Вид через окуляр спектроскопа был показан на рис. 3. Спектроскопы удобны для определения спектрального состава излучения, но плохо подходят для измерения относительного количества света с разными длинами волн. Они применяются главным образом для качественной эмиссионной спектроскопии. Рис. 7. Схема простого спектроскопа. Спектрометры
Спектрометр — это спектроскоп, который оснащен каким-либо измерительным прибором, позволяющим определять количество света (число фотонов) на разных длинах волн. Его назначение в том, чтобы численно охарактеризовать испускание или поглощение света на определенной длине волны. Оператор может изменять длину волны, для которой определяется поглощение или пропускание образца. Таким способом можно узнать, какие длины волн присутствуют в излучении и в каком относительном количестве. Спектрометры широко применяются в астрономии для исследования спектрального состава света, собранного телескопами. Они являются единственными приборами, дающими нам информацию о химическом составе вселенной за пределами солнечной системы. Рис. 8. Схема простого спектрометра. Свет попадает в спектрометр через входную щель, а затем проходит через ряд оптических элементов: коллимирующую линзу, дифракционную решетку и выходную щель. Такая оптическая схема характерна для монохроматоров — устройств, выделяющих только один цвет (фактически, очень узкий интервал длин волн) из всех длин волн (цветов), присутствующих в излучении источника. Длину волны можно выбирать поворотом дифракционной решетки. Различные длины волн отражаются от решетки под разными углами, в результате чего белый свет разлагается в «радугу», как при прохождении через стеклянную призму. Выбранная длина волны является центром узкого интервала длин волн, который выделяется выходной щелью.
Далее свет попадает на детектор, который генерирует напряжение, пропорциональное интенсивности падающего света. Это напряжение передается на отсчетное устройство, которое выдает результат в удобных единицах измерения.
На конструкцию и работу спектрометров (как и всех электронных устройств) сильное влияние оказали технологические достижения второй половины ХХ века. По-видимому, наибольшее значение имела разработка приборов с зарядовой связью (ПЗС) в начале 1970-х гг. Первоначально их придумали для хранения данных, но скоро обнаружилось, что они весьма перспективны и как устройства для получения изображений. По существу, такое устройство электронным способом имитирует фотопленку. Прибор с зарядовой связью состоит из отдельных светочувствительных элементов, между которыми можно переносить электрический заряд. Свет, падающий на массив таких элементов, создает распределение зарядов, которое соответствует изображению. Затем это изображение электронным способом переносится в другое место, например, на монитор, и реконструируется. Первоначально ПЗС использовались для замены фотографических пластинок в телескопах. Первое такое устройство было установлено на метровом телескопе Национальной обсерватории Kitt Peak в 1979 г. В наши дни ПЗС позволили создать доступные по цене цифровые видеокамеры.
Вскоре после успешного применения ПЗС в астрономических задачах было обнаружено, что они могут сильно улучшить характеристики спектрометров. Для этого выходная щель и детектор заменялись на матрицу ПЗС. Теперь уже не требовалось измерять интенсивность света последовательно на каждой длине волны. Количеств длин волн, которые могут наблюдаться одновременно, определяется числом элементов в матрице. На рис. 9 приведена схема спектрометра, оснащенного ПЗС-детектором. Матрица генерирует выходной сигнал, по которому можно восстановить интенсивность света, падающего на каждый элемент массива. Этот выходной сигнал может быть направлен на монитор или принтер для визуализации. Прибор дает мгновенный отклик сразу во всем спектральном диапазоне, и больше не требуется сканировать спектр в разных направлениях для измерения интенсивности на отдельных длинах волн. Рис. 9. Схема ПЗС-спектрометра. Спектрофотометры
Поскольку спектрометры измеряют количество света, попавшего в прибор, они чаще всего используются для эмиссионной спектроскопии. Для абсорбционной спектроскопии требуется источник излучения известной интенсивности. Прибор, который включает в себя такой источник, называется спектрофотометром. Он конструируется таким образом, чтобы подлежащий изучению образец мог облучаться светом с известной длиной волны и интенсивностью. Длину волны можно изменять; для каждой длины волны измеряется количество излучения, поглощенного или пропущенного образцом. По этим данным можно получить спектр поглощения и использовать его для качественного и количественного анализа.
Спектрофотометры измеряют количество света, прошедшего через образец, а затем преобразуют эту величину в более удобные величины. Одной из них является отношение прошедшего света (I) к падающему (I0) — коэффициент пропускания (обычно выражается в процентах и обозначается %T):
. (2)
Расчет %T легко встроить в спектрофотометр, и до появления микропроцессоров эта величина являлась стандартным выходным сигналом. Более полезной величиной является оптическая плотность (обозначаемая как A или D), поскольку она прямо пропорциональна молярной концентрации поглощающих веществ. Оптическая плотность связана с коэффициентом пропускания следующим образом:
. (3)
При расчете коэффициента пропускания или оптической плотности всегда делается неявное предположение, что весь свет, который не дошел до детектора, поглотился растворенными химическими соединениями. Однако есть и две другие возможности. Во-первых, свет рассеивается раствором. Из-за этого мутные растворы и взвеси трудно анализировать при помощи спектрофотометра. Образцы, с которыми приходится иметь дело в коммерческих лабораториях (биологические жидкости, растворы почв и т. д.), часто оказываются мутными, поэтому до того, как анализировать их методом абсорбционной спектрофотометрии, необходимо предпринять дополнительные шаги.
Во-вторых, свет может рассеиваться или поглощаться контейнером, в котором содержится раствор. Должны быть приняты меры к тому, чтобы кюветы с образцом не влияли на измерения. Эти кюветы должны быть изготовлены из абсолютно бесцветного стекла. Если измерения должны проводиться на длинах волн короче 350 нм, то стекло должно быть кварцевым. Обычные стекла теряют прозрачность после 350 нм.
Закон Бугера-Ламберта-Бера
Соотношение между оптической плотностью и концентрацией известно как закон Бугера-Ламберта-Бера, иногда называемого просто законом Бера:
A = εСL, (4)
где:
A — измеренная оптическая плотность,
С — концентрация поглощающего вещества,
L — длина оптического пути в образце (длина кюветы),
ε — коэффициент пропорциональности, называемый молярным коэффициентом поглощения и измеряемый в единицах M–1 ∙ см–1).
Молярный коэффициент поглощения является константой для данного химического соединения и данной длины волны. Для большинства соединений существует как минимум одна длина волны, на которой ε достигает максимума. Эта длина волны часто выбирается для абсорбционной спектрофотометрии соединения. Рассмотрим, например, видимый спектр поглощения гемоглобина (рис. 5). В видимом диапазоне есть три подходящих длины волны: 412, 541 и 576 нм.
Если известен молярный коэффициент поглощения на определенной длине волны, то концентрацию химического соединения в прозрачной среде можно рассчитать по измеренной оптической плотности при помощи закона Бера. Простейший способ определить ε — это взять раствор известной концентрации, выбрать длину волны, на которой нужно получить ε (обычно это длина волны, где ε достигает максимума), измерить оптическую плотность и длину пути. Приведенное выше уравнение можно решить относительно ε (получим ε = A / СL) и вычислить искомую величину по экспериментальным данным. Однако результат может оказаться ненадежным. Например, широко распространенный спектрофотометр Spectronic 20 дает надежные результаты только в диапазоне оптических плотностей от 0.01 до 1.5. Значение за пределами данного диапазона будет сомнительным. Не исключены также неисправность прибора или ошибка оператора. Поэтому для получения правдоподобного результата требуются многочисленные измерения нескольких образцов в разных условиях.
Более точным методом определения ε является измерение оптических плотностей нескольких растворов с разными концентрациями и построение калибровочной кривой. Закон Бера является линейным уравнением вида y = mx + b, в котором b — отрезок, отсекаемый по оси y — равен нулю. Зависимость оптической плотности от концентрации должна представлять собой прямую линию с тангенсом угла наклона, равным εL. Пример такой зависимости показан на рис. 10. Поскольку b = 0, нулевая концентрация должна давать нулевой коэффициент поглощения, и прямая будет проходить через начало координат (0, 0).
Определение ε требует определения наклона кривой, наилучшим образом проходящей через экспериментальные точки. Рассмотрим данные, представленные на Рис. 10. Рис. 10. Калибровочный график. Коэффициент наклона можно рассчитать по координатам двух точек. Чтобы избежать систематической погрешности (смещения), эти точки не должны совпадать с экспериментальными.
(5)
Коэффициент наклона позволяет определить ε, если известна длина пути света в образце. Можно измерить длину пути линейкой, однако более строгий метод заключается в том чтобы измерить оптическую плотность эталонного раствора с известной концентрацией и молярным коэффициентом поглощения, а затем определить длину пути из закона Бера.
Нужно заметить, что значение L может меняться от кюветы к кювете. Оно также будет меняться при изменении ориентации кюветы в держателе, если кювета не имеет одинакового размера во всех направлениях. Для поддержания оптимальной точности следует всегда пользоваться одной и той же кюветой и проверять ее ориентацию при каждой установке в спектрофотометр.
Калибровочный график можно использовать и для определения неизвестной концентрации образца, если измерен его коэффициент поглощения. Это делается путем интерполяции. В примере на рис. 11 коэффициенту поглощения 0.45 соответствует концентрация 2.7 х 10–5 M. Рис. 11. Интерполяция концентраций.
Приборы, используемые в практикуме
Для наблюдения и измерения спектров вы будете использовать три различных прибора. Их описания приведены ниже.
Спектроскоп Гертнера (Gaertner®)
Этот прибор ненамного отличается от спектроскопов, использовавшихся Густавом Кирхгофом и Робертом Бунзеном (изобретателем бунзеновской горелки) при разработке научных основ эмиссионной спектроскопии в 1850-х годах. Он показан на рис. 12, а его схема приводилась на рис. 7. С его помощью можно проводить качественный эмиссионный анализ с достаточно яркими источниками света. Порядок работы с этим прибором кратко описан ниже.
- Найдите узкую щель на конце коллимирующей трубки. Направьте щель на изучаемый источник света. Смотрите в телескоп и двигайте прибор из стороны в сторону, держа за основание, пока наблюдаемый свет не станет наиболее ярким. Если света не видно, попробуйте подвигать телескоп при помощи расположенной под ним ручки. (Начинать лучше всего со среднего положения телескопа).
- Включите настольную лампу и направьте ее свет в трубку освещения шкалы. Смотрите через телескоп на шкалу. Она должна быть строго горизонтальна. Если это не так, аккуратно поверните конец осветительной трубки, чтобы вернуть шкалу в горизонтальное положение.
- Сфокусируйте изображение шкалы, перемещая окуляр телескопа. Отрегулировав спектроскоп, постарайтесь его больше не двигать.
- Перемещая телескоп при помощи расположенной под ним ручки, рассмотрите весь спектр. Глядя в телескоп, определите положение цветных линий на освещенной шкале. Запишите эти значения. Положение следует интерполировать с точностью до 0.01 (единиц измерения здесь нет). Лучше всего действовать следующим образом: вместо того, чтобы пытаться определить положение центра линии, искать положение резкой границы. Каждая линия будет иметь четко выраженную левую границу и размытую правую.
Спектрометр USB4000 фирмы Ocean Optics
Это быстрый и простой в использовании прибор для получения ультрафиолетовых и видимых спектров от любого источника. Все элементы спектрометра (зеркала, решетка, щель и детектор) размещены в оптическом модуле, который легко помещается на ладони. Рис. 13. Спектрометр Ocean Optics с линейным ПЗС-детектором Toshiba.
Свет, введенный в спектрометр по оптическому волокну или напрямую из окружающего пространства, разлагается в спектр неподвижной решеткой. Спектр проецируется на линейный ПЗС-детектор, который дает значения интенсивности в 3648 равноотстоящих точках выбранного спектрального диапазона. Выходной сигнал детектора передается в компьютер через интерфейс USB, обрабатывается и отображается на мониторе в отсчетах (counts) за миллисекунду. (Один отсчет примерно эквивалентен одному фотону, попавшему на детектор). Таким образом, отображаемый результат измерения содержит более 3500 различных значений, переданных в компьютер и обработанных программой. Это происходит с достаточной скоростью, чтобы вы могли наблюдать спектры в реальном времени.
Эмиссионные измерения при помощи программы SpectraSuite фирмы Ocean Optics
Запустите SpectraSuite, нажав кнопку Start и выбрав All Programs | Ocean Optics | SpectraSuite | SpectraSuite. На рис. 14 показана панель инструментов, которая появится в верней части экрана. Рис. 14. Панель инструментов SpectraSuite.
- Включите источник высокого напряжения, чтобы зажечь гелиевую газоразрядную трубку. Отрегулируйте напряжение так, чтобы разряд горел стабильно. Не устанавливайте максимальное напряжение без консультации с преподавателем.
ПРЕДУПРЕЖДЕНИЕ
Источник питания газоразрядных трубок выдает напряжение от 5000 до 7000 вольт. Не дотрагивайтесь до открытых металлических соединений, чтобы не получить опасный электрический удар.
- Выровняйте световод относительно разрядной трубки и отрегулируйте его положение так, чтобы спектральные линии в окне SpectraSuite имели максимальную высоту.
- Просмотрите спектр. Его максимум должен быть в верхней части окна, но не за пределами шкалы. Если спектр слишком велик или мал, необходимо отрегулировать время интегрирования (время в миллисекундах, в течение которого прибор считает приходящие фотоны). Оптимальное время интегрирования подбирается методом проб и ошибок. Найдите соответствующий элемент управления в левой части панели инструментов и изменяйте его значение, пока не получите нужную величину сигнала. Для идентификации очень слабых пиков в эмиссионных спектрах может потребоваться длительное интегрирование.
- Получив устраивающий вас спектр, нажмите кнопку сохранения () на панели инструментов SpectraSuite. Дайте файлу имя и сохраните его. Затем нажмите кнопку наложения спектральных данных (), чтобы иметь возможность просматривать и анализировать текущие спектры.
- Щелкните на экране, чтобы активизировать курсор. Он нужен для определения длины волны и интенсивности каждой линии или пика, которые вас будут интересовать. Щелкните на экране, и курсор будет двигаться в этом направлении. Определите длины волн всех линий, которые вы можете идентифицировать. Запишите эти длины волн, а также соответствующие им интенсивности сигналов.
- Аккуратно отодвиньте гелиевую трубку и замените ее водородной. Отрегулируйте положение световода так, чтобы линии имели максимальную высоту. Снова используйте курсор для считывания положений и интенсивностей линий. В желто-оранжевой области цвета будут размытыми. Не записывайте данные по тем линиям, которые могут наблюдаться в этой области. Они имеют другое происхождение по сравнению с остальными линиями и не поддаются математической обработке.
- Повторите шаги 2–6, используя водородную газоразрядную трубку.
Использование USB4000 в качестве спектрофотометра
Спектрометр USB4000 можно использовать и для измерения оптической плотности, если соединить его с вольфрамовым источником света и держателем кюветы, как показано на рис. 15. Для измерения коэффициента поглощения прибор необходимо откалибровать. Для этого сначала записывается число отсчетов в каждом из 3648 элементах детектора при пропускании света источника через эталонный раствор (воду). Затем записывается число отсчетов, когда свет от источника перекрыт. Обе операции выполняются программой автоматически после нажатия соответствующих кнопок. Как только прибор откалиброван и образец вставлен в держатель, компьютер вычисляет отношение текущего числа отсчетов к сохраненному для каждого из 3648 элементов, рассчитывает оптические плотности и строит на экране график. Как и прежде, все происходит настолько быстро, что кажется почти мгновенным. Рис. 15. USB4000 в качестве спектрофотометра. Измерение поглощения при помощи программы SpectraSuite
- Запустите SpectraSuite, нажав кнопку Start и выбрав All Programs | Ocean Optics | SpectraSuite | SpectraSuite. На рис. 16 показана панель инструментов, которая появится в верхней части экрана.
Рис. 16. Панель инструментов SpectraSuite
- Запишите спектр поглощения кюветы, заполненной растворителем (водой), и сохраните его как эталонный. Для этого выберите File | Store | Store Reference Spectrum или щелкните на в панели инструментов.
- Полностью перекройте свет от источника, вставив кусок темной бумаги между источником и кюветой. Выберите File | Store | Store Dark Spectrum, чтобы сохранить темновой спектр в файл. Можно также щелкнуть на в панели инструментов. Затем уберите бумагу.
- Нажмите кнопку «Режим поглощения» (). Это переведет спектрофотометр в режим измерения оптической плотности. Теперь вы готовы к получению спектров поглощения.
- Вы можете отрегулировать параметры отображения, используя функции автоматического масштабирования по высоте () и ручной установки диапазонов (). Для этого эксперимента вам потребуется функция установки масштаба по оси длин волн, чтобы задать диапазон 400–700 нм.
- Ополосните кювету раствором, предназначенным для измерения, и заполните ее этим же раствором. Вставьте кювету в держатель. Сделайте снимок спектра, выбрав пункт меню File | Screen Capture и нажав кнопку Accept в появившемся диалоговом окне. Это позволит «заморозить» спектр на экране. Распечатайте спектр, щелкнув на значке в панели инструментов SpectraSuite.
- Повторите шаг 6 для всех имеющихся красителей.
Спектрофотометр Spectronic 20®
Это самый известный и наиболее широко используемый спектрофотометр из всех когда-либо выпускавшихся. Впервые появившийся более 40 лет назад, этот прочный и надежный прибор обеспечивает точное измерение оптической плотности в диапазоне от 325 до 650 нм. Единственное, чего он не умеет делать — это выдавать полные спектры; за одно измерение можно получить только одно значение на одной длине волны.
Spec 20® имеет очень простой дизайн, показанный на рис. 17. Источником оптического излучения служит вольфрамовая лампа, а щель имеет ширину около 20 нм.
Рис. 17. Спектрофотометр Spec 20®
Яркость лампы и отклик детектора сильно меняются в пределах видимого спектра. В отличие от спектрометра USB4000 фирмы Ocean Optics, здесь не предусмотрено сохранение эталонного спектра и темнового тока, поэтому требуется выставлять нуль при каждой смене длины волны. После настройки на определенную длину волны эффективнее всего измерить оптическую плотность у всех исследуемых растворов, и только после этого переходить к следующей длине волны.
Spec 20® должен надежно работать в диапазоне от 400 до 640 нм. Часто он работает и при гораздо более коротких длинах волн, до 325 нм. О работе вне диапазона 400–640 нм можно сказать следующее: если вам удалось выставить нуль, то можете смело проводить измерения.
Работа со спектрофотометром Spec 20®
Ниже приведены пояснения к краткой инструкции, присутствующей на большинстве приборов (рис. 18).
Рис. 18. Органы управления и индикации Spec 20®
- Установите нужную длину волны при помощи ручки, находящейся рядом с окошком индикатора длин волн.
- При пустом и закрытом отделении для образцов установите стрелку индикатора в начало шкалы (нулевое пропускание, или бесконечная оптическая плотность), вращая левую переднюю ручку.
- Прибор Spec 20 рассчитан на использование круглых кювет; подходящий размер имеют стандартные 4-дюймовые пробирки. Ввиду того, что они не идеально круглые (измерение диаметра в разных направлениях дает разные результаты), их следует устанавливать в держатель всегда в одном и том же положении. Для этого в отделении для образцов есть риска, с которой нужно совмещать риску, сделанную на кювете.
- Вставьте реперную кювету (чистая кювета с дистиллированной водой) в отделение для образцов, соблюдая ориентацию. Убедитесь, что крышка отделения закрыта. Вращайте правую переднюю ручку, пока индикатор не будет показывать пропускание 100% (нулевая оптическая плотность). Учтите, что для установки максимальных показаний во всем рабочем диапазоне требуется много полных оборотов этого регулятора.
Замените реперную кювету на кювету с образцом. Выровняйте кювету. Убедитесь, что крышка отделения для образцов закрыта. Считайте и запишите оптическую плотность. |







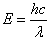 , (1)
, (1)
